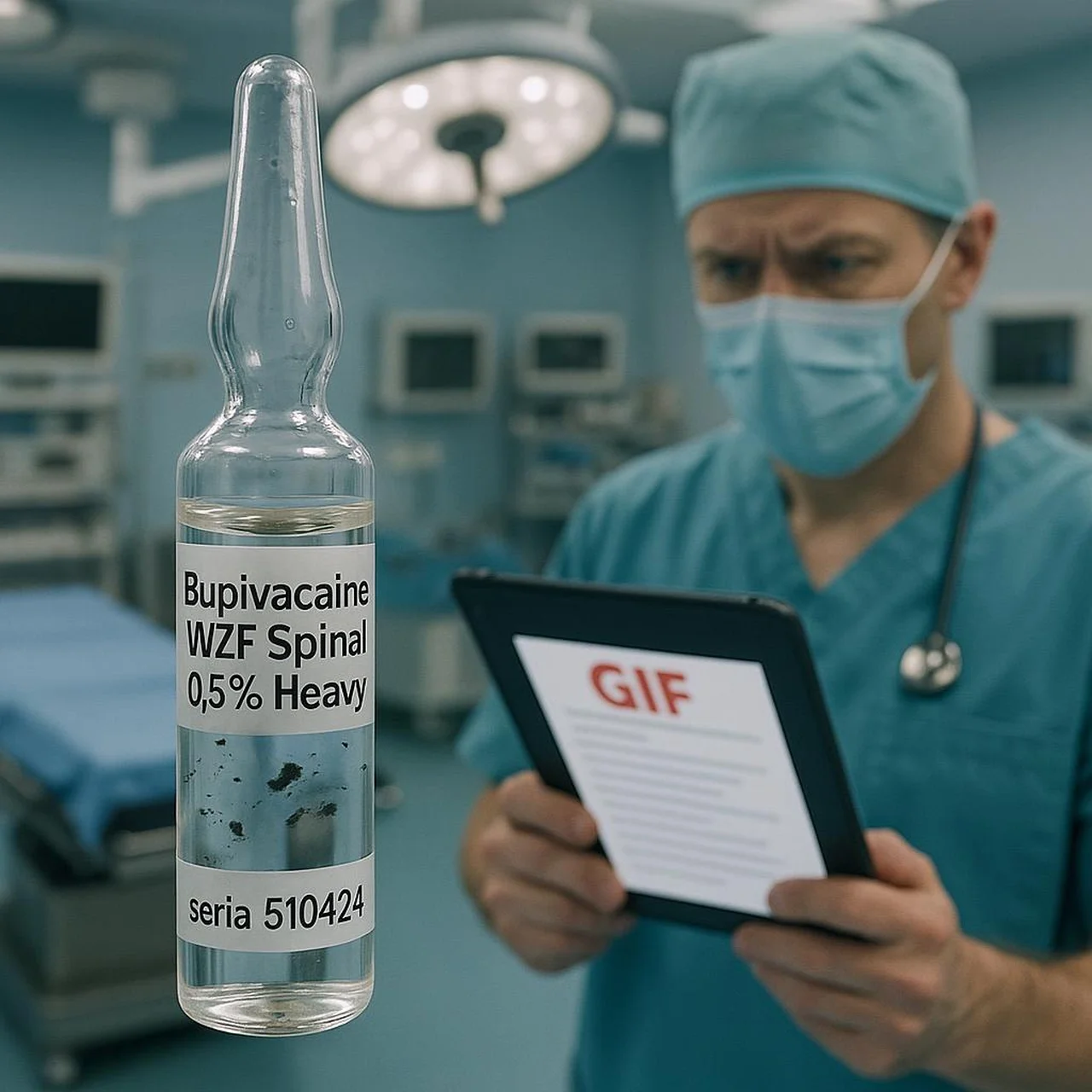
🩺 Bupiwakaina jest od lat jednym z filarów anestezji przewodowej. Dlatego każda informacja o jej dostępności lub jakości elektryzuje środowisko medyczne. 8 lipca 2025 r. Główny Inspektor Farmaceutyczny (GIF) opublikował decyzję nr 24/WC/ZW/2025, nakazującą natychmiastowe wycofanie z obrotu serii 510424 leku Bupivacaine WZF Spinal 0,5% Heavy. Poniżej wyjaśniamy, co dokładnie się stało, jakie są konsekwencje dla praktyki klinicznej oraz jak powinni zareagować pacjenci i profesjonaliści ochrony zdrowia.
1. Co to za lek i do czego służy?
Bupivacaine WZF Spinal 0,5% Heavy zawiera chlorowodorek bupiwakainy w stężeniu 5 mg/ml. Lek jest stosowany do znieczuleń podpajęczynówkowych – m.in. przy cesarskich cięciach, zabiegach ortopedycznych czy operacjach jamy brzusznej. Jego „Heavy” – czyli hiperbaryczna – postać zapewnia kontrolowane rozprzestrzenianie środka znieczulającego w płynie mózgowo-rdzeniowym, co przekłada się na przewidywalniejszy zakres blokady nerwowej.
2. Szczegóły decyzji GIF
Decyzja opiera się na art. 122 ust. 1 Prawa farmaceutycznego, który zobowiązuje GIF do wycofania produktu, jeżeli nie spełnia on wymagań jakościowych. Kluczowe punkty dokumentu: - Wycofanie dotyczy wyłącznie serii 510424, termin ważności 04.2027. - Forma pakowania: 5 ampułek po 4 ml (GTIN 05909990634491). - Lek zarejestrowany pod numerem pozwolenia 14325; podmiot odpowiedzialny – Zakłady Farmaceutyczne POLPHARMA S.A. - Decyzji nadano rygor natychmiastowej wykonalności, co oznacza, że obowiązuje od chwili doręczenia i nie czeka na uprawomocnienie.
3. Dlaczego lek wycofano? 🧪
Wszystko zaczęło się od reklamacji zgłoszonej przez jeden ze szpitali, który zauważył ciemne, nierozpuszczalne cząstki w ampułce. Polpharma przeprowadziła analizę: 1. Przegląd wizualny próby archiwalnej potwierdził zanieczyszczenia w 2 kolejnych ampułkach. 2. Wstępna identyfikacja wykazała, że cząstki powstały w trakcie procesu technologicznego – doszło do zwęglenia roztworu podczas zatapiania ampułek. 3. Nie stwierdzono wady w innych seriach leku. Wada jakościowa została więc uznana za odosobnioną dla serii 510424, ale zgodnie z prawem nawet niewielkie ryzyko wymaga wycofania całej partii.
4. Ryzyko kliniczne 💉
Bupiwakaina jest podawana bezpośrednio do przestrzeni podpajęczynówkowej, gdzie każda obca cząstka może wywołać: - podrażnienie opon mózgowych, - reakcję zapalną, - zaburzenia przewodnictwa nerwowego, - potencjalnie powikłania neurologiczne, np. arachnoiditis. Dlatego nawet minimalna ilość zanieczyszczeń jest nieakceptowalna. GIF podkreśla, że pozostawienie leku w obrocie „nie pozwala wykluczyć zagrożenia dla zdrowia ludzkiego”.
5. Co muszą zrobić szpitale i apteki? 🏥
- Natychmiast wstrzymać sprzedaż i stosowanie serii 510424.
- Oznaczyć opakowania jako „WYCOFANE – nie stosować”.
- Sporządzić protokół zwrotu lub zniszczenia zgodnie z rozporządzeniem Ministra Zdrowia z 12 marca 2008 r.
- W systemie ZSMOPL i systemach serializacyjnych (zgodnie z rozporządzeniem UE 2016/161) oznaczyć niepowtarzalne identyfikatory jako wycofane.
- Odesłać produkt do hurtowni bądź producenta, oczekując instrukcji dalszego postępowania.
6. Jak powinni zareagować pacjenci? 👩⚕️
- Nie ma wskazań do paniki – wycofanie dotyczy ściśle określonej serii.
- Jeżeli pacjent otrzymał znieczulenie z tej partii, powinien obserwować miejsce wkłucia i ogólny stan zdrowia; w razie bólów pleców, gorączki lub objawów neurologicznych natychmiast zgłosić się do lekarza.
- Osoby posiadające ampułki w domowej torbie pierwszej pomocy (np. ratownicy medyczni) powinny zwrócić je do najbliższej apteki.
7. Konsekwencje dla anestezjologów i ratowników medycznych
- Konieczność weryfikacji numeru serii przed każdym znieczuleniem.
- Możliwe chwilowe niedobory bupiwakainy hiperbarycznej; szpitale powinny opracować plan B – np. stosowanie innych stężeń bupiwakainy lub lidokainy (o ile procedura to umożliwia).
- Szkolenia personelu w zakresie identyfikacji wycofanych leków w magazynach operacyjnych.
8. Reakcja Polpharmy
Polpharma poinformowała, że: - przeprowadziła inspekcję linii produkcyjnej, - zidentyfikowała przyczynę zwęglenia i wdrożyła korekty procesu zatapiania ampułek, - współpracuje z GIF w zakresie komunikacji do hurtowni i szpitali, - analizuje możliwość dobrowolnego zastąpienia wadliwej serii nową partią wolną od zanieczyszczeń.
„Bezpieczeństwo pacjentów pozostaje naszym priorytetem” – czytamy w oświadczeniu prasowym spółki.
9. Statystyki wycofań leków 2024–2025 🔎
Według danych GIF: - W 2024 r. odnotowano 67 decyzji o wycofaniu serii produktów leczniczych. - Do lipca 2025 r. wydano już 39 decyzji, z czego 8 dotyczyło leków stosowanych w anestezji i intensywnej terapii. Narastająca liczba alertów odzwierciedla zaostrzone normy GMP i coraz skuteczniejsze systemy farmakovigilancji.
10. Rola systemu serializacji
Zgodnie z dyrektywą 2011/62/UE każde opakowanie leku posiada unikalny kod 2D. Przy wycofaniu serii: - posiadacz pozwolenia musi „wyrejestrować” kody z krajowego repozytorium, - apteki są zobligowane do skanowania kodów, co minimalizuje ryzyko przypadkowego wydania wadliwego leku.
11. Jak branża zapobiega podobnym incydentom? 🏭
- Kwalifikacja dostawców szkła – analiza składu rurka-szkło, by ograniczyć ryzyko reakcji z roztworem.
- Monitorowanie temperatury pieca zatapiającego – zwęglenie może nastąpić, gdy temperatura przekroczy optymalny zakres.
- Wizualna inspekcja 100 % ampułek przy użyciu kamer high-speed.
- Testy czystości podłoża (subvisible particles) w standardzie USP <788>.
12. Alternatywy terapeutyczne
- Bupivacaine 0,5% plain (izobaryczna) – wymaga innej techniki ustawienia pacjenta.
- Levobupivacaine 0,5% – enancjomer o korzystniejszym profilu kardiotoksyczności.
- Ropivacaine 0,75% – popularna w analgezji porodowej. Lekarz wybiera zamiennik, uwzględniając rodzaj operacji, czas trwania blokady i profil bezpieczeństwa.
13. Perspektywa prawna i ekonomiczna ⚖️
- Zgodnie z art. 67 ust. 1–2 Prawa farmaceutycznego, produkt niespełniający wymagań podlega zniszczeniu; decyzja GIF nie przewiduje innego wykorzystania wadliwej partii.
- Szpitale mogą dochodzić rekompensaty finansowej od producenta za koszty utylizacji i zastąpienia leku.
- Ubezpieczyciele klinik operacyjnych bacznie obserwują procedury, aby zminimalizować ryzyko roszczeń pacjentów.
14. Kroki dla personelu medycznego – checklista ✅
- Sprawdź zapasy bupiwakainy – czy masz serię 510424?
- Jeśli tak, natychmiast ją izoluj i oznacz.
- Poinformuj zespół anestezjologiczny.
- Zgłoś ilość do działu farmacji szpitalnej.
- Wypełnij formularz zwrotu do hurtowni lub producenta.
- Zanotuj alternatywny protokół znieczulenia w dokumentacji zabiegów planowanych.
15. Najczęściej zadawane pytania (FAQ) ❓
Czy inne stężenia bupiwakainy Polpharmy są bezpieczne? Tak – producent i GIF nie stwierdzili wady w pozostałych partiach.
Czy mogę zwrócić lek bez paragonu? Tak. Wycofanie dotyczy bezpieczeństwa zdrowia publicznego; apteka przyjmie ampułki niezależnie od dowodu zakupu.
Co, jeśli przypadkowo podałem pacjentowi lek z tej serii? Należy obserwować pacjenta, udokumentować zdarzenie, zgłosić do systemu Baza Danych Zdarzeń Niepożądanych (BLOZ) i poinformować GIF.
16. Podsumowanie 📝
Wycofanie serii Bupivacaine WZF Spinal 0,5% Heavy to przykład sprawnego działania systemu nadzoru farmaceutycznego w Polsce. Choć wada dotyczyła pojedynczych ampułek, potencjalne ryzyko neurologiczne wymagało stanowczej reakcji. Szpitale, apteki i pacjenci muszą bezwzględnie podporządkować się decyzji GIF, aby zminimalizować zagrożenie dla zdrowia. Produkcja leków wysokiego ryzyka, jak środki do znieczuleń przewodowych, wymaga rygorystycznej kontroli – i ta sytuacja przypomina całemu sektorowi, że jakość nie jest dodatkiem, lecz fundamentem bezpieczeństwa terapeutycznego.
17. Źródła 🌐
- Główny Inspektorat Farmaceutyczny – Decyzja nr 24/WC/ZW/2025 z 8 lipca 2025 r.
- Ustawa z dnia 6 września 2001 r. – Prawo farmaceutyczne (Dz.U. 2025 poz. 750).
- Rozporządzenie Ministra Zdrowia z 12 marca 2008 r. (Dz.U. 2022 poz. 969).
- Rozporządzenie delegowane Komisji (UE) 2016/161 z 2 października 2015 r.
- Dane statystyczne GIF dotyczące decyzji jakościowych 2024–2025 (https://www.gov.pl/web/gif).