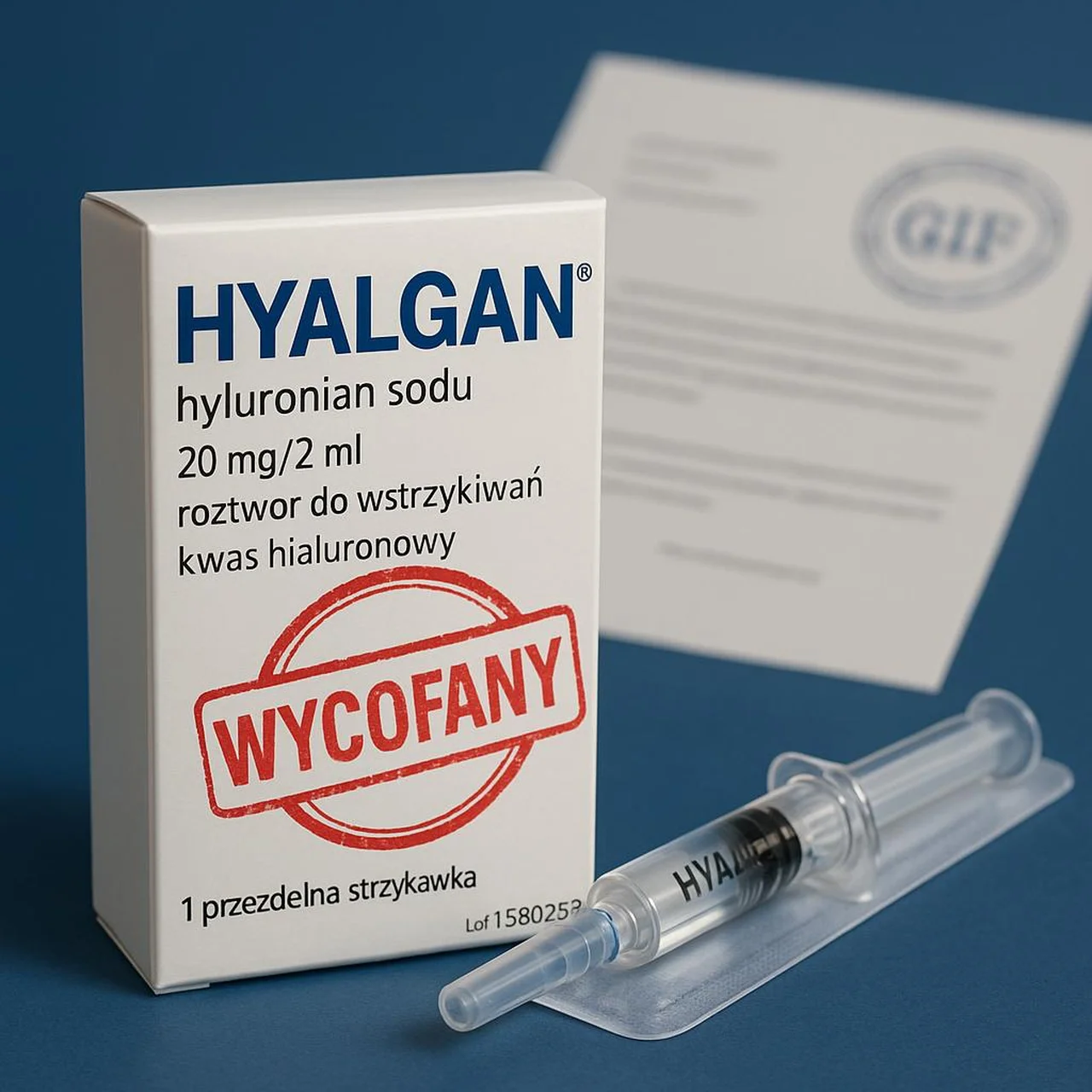
Dlaczego zdecydowano się na tak drastyczny krok? 🤔
18 lipca 2025 r. Główny Inspektor Farmaceutyczny (GIF) opublikował decyzję nr 25/WC/ZW/2025, którą nadał rygor natychmiastowej wykonalności. Tym samym dwie serie preparatu Hyalgan – H19960 oraz F32680 – muszą zniknąć z hurtowni i aptek w całej Polsce. Kluczowym powodem jest brak ATD (anti-tampering device), czyli zabezpieczenia uniemożliwiającego naruszenie opakowania. ⚠️
Co to jest ATD i dlaczego ma znaczenie? 🔒
ATD to element plomby albo perforacji, który pęka przy pierwszym otwarciu pudełka. Brak takiego zabezpieczenia sprawia, że ktoś niepowołany może podmienić strzykawkę lub jej zawartość, a pacjent, lekarz czy farmaceuta nie zauważy ingerencji. Dyrektywa 2001/83/WE oraz Rozporządzenie Delegowane (UE) 2016/161 nakładają obowiązek stosowania ATD w lekach wydawanych z przepisu lekarza, szczególnie gdy są one narażone na fałszerstwa.
Krótka charakterystyka leku Hyalgan 💉
Hyalgan zawiera kwas hialuronowy (Natrii hyaluronas) w stężeniu 10 mg/ml. W medycynie stosuje się go głównie:
- Do terapii iniekcyjnej w chorobie zwyrodnieniowej stawów kolanowych i biodrowych.
- W medycynie estetycznej – jako wypełniacz zwiększający elastyczność skóry.
- W zabiegach ortopedycznych poprawiających lepko-sprężystość płynu stawowego.
Preparat występuje w jednorazowej ampułko-strzykawce 2 ml. Pacjenci podkreślali jego skuteczność w zmniejszaniu bólu stawu nawet na 6 miesięcy. Dlatego informacja o wycofaniu wywołała duże poruszenie w środowisku reumatologów i ortopedów.
Jak doszło do wykrycia nieprawidłowości? 🔍
• Pierwsze sygnały zgłosili pracownicy hurtowni farmaceutycznych z kilku województw. • Zauważyli, że opakowania nie mają plomby ATD. • GIF wszczął postępowanie, a producent – Fidia Farmaceutici S.p.A. z Padwy – potwierdził błąd w specyfikacjach kartoników. • Firma zablokowała stany magazynowe serii H19960, jednak część opakowań była już w aptekach.
Choć producent ocenił ryzyko fałszerstw jako niskie, organ nadzorczy nie podzielił tej opinii. W ocenie GIF koszt potencjalnego zagrożenia dla zdrowia i reputacji legalnego łańcucha dostaw przewyższał korzyści z dalszej sprzedaży.
Źródło decyzji: https://www.gov.pl/web/gif
Co musi zrobić apteka i hurtownia? 🏥
- Natychmiast wycofać wszystkie opakowania z wyżej wymienionych serii.
- Oznaczyć je statusem „WYCOFANE” w Zintegrowanym Systemie Monitorowania Obrotem Produktami Leczniczymi (ZSMOPL).
- Przechowywać osobno do czasu ich zniszczenia zgodnie z art. 67 ust. 1 Prawa farmaceutycznego.
- Powiadomić lekarzy i klientów o procedurze zwrotu.
Co powinien zrobić pacjent? 👨⚕️👩⚕️
- Sprawdzić numer serii na pudełku i na strzykawce.
- Jeśli numer to H19960 lub F32680, nie stosować preparatu.
- Zwrócić lek do apteki, w której został kupiony, i poprosić o zwrot pieniędzy lub zamiennik.
- Zachować paragon lub fakturę – ułatwi to procedurę reklamacyjną.
Czy grożą mi skutki uboczne? 🚑
Brak ATD nie wpływa na skład chemiczny ampułko-strzykawki, ale eliminuje jeden z filarów bezpieczeństwa pacjenta – pewność, że produkt nie był otwierany. Ewentualne użycie preparatu niewiadomego pochodzenia może skutkować:
• zakażeniem bakteryjnym stawu, • reakcją alergiczną na zanieczyszczenia, • brakiem efektu terapeutycznego i koniecznością ponownego zabiegu.
Alternatywy dla Hyalgan – przegląd rynku 🔄
Na szczęście na polskim rynku dostępne są inne, zarejestrowane preparaty z kwasem hialuronowym do iniekcji dostawowej:
| Preparat | Stężenie HA | Producent | |----------|-------------|-----------| | Ostenil | 10 mg/ml | TRB Chemedica | | Synvisc One | 8 mg/ml | Sanofi Genzyme | | Durolane | 20 mg/ml | Bioventus | | Go-On | 25 mg/2,5 ml | Rottapharm |
Zanim lekarz przepisze zamiennik, powinien wziąć pod uwagę: wiek pacjenta, stadium choroby, liczbę iniekcji oraz cenę kuracji.
Znaczenie decyzji dla medycyny estetycznej 💄
Medycyna estetyczna od lat wykorzystuje kwas hialuronowy do wypełniaczy skórnych. Wycofanie serii Hyalgan – choć przeznaczonego głównie do stawów – przypomniało klinikom, że muszą:
- Kupować produkty wyłącznie z legalnego źródła.
- Sprawdzać hologramy, numery partii oraz ATD.
- Prowadzić ewidencję zużycia preparatu – od przyjęcia w magazynie do podania pacjentowi.
Co dalej z Fidą Farmaceutici? 🏭
Producent zobowiązał się do wprowadzenia działań korygujących:
• aktualizacja specyfikacji kartonika, • pełny audyt łańcucha pakowania, • wdrożenie dodatkowego monitoringu linii produkcyjnej.
Jeśli firma nie wykaże zgodności z przepisami, GIF może rozszerzyć decyzję na kolejne partie lub zawiesić pozwolenie nr 01456.
Przepisy prawne w pigułce 📜
• Art. 122 ust. 1 Prawa farmaceutycznego – podstawowy przepis umożliwiający wycofanie z obrotu leku niespełniającego wymogów jakości. • Art. 42 ust. 1 pkt 15 tej samej ustawy – nakłada obowiązek stosowania zabezpieczeń ATD. • Rozporządzenie Delegowane (UE) 2016/161 – definiuje, jak ma wyglądać anti-tampering device. • Art. 108 § 1 KPA – pozwala nadać decyzji rygor natychmiastowej wykonalności ze względu na zdrowie publiczne.
Pełny tekst ustawy: https://isap.sejm.gov.pl
Jak rozpoznać oryginalny produkt z kwasem hialuronowym? 🧐
- Numer pozwolenia na dopuszczenie do obrotu (w Polsce 5 cyfr).
- GTIN lub kod EAN czytelny na skanerze.
- Dwuwymiarowy kod Datamatrix z numerem seryjnym.
- Nienaruszone ATD – kartonik musi „zaskoczyć” przy otwarciu.
- Ulotka w języku polskim z datą i numerem wersji.
Jeśli któryś element budzi wątpliwości, warto skorzystać z aplikacji „Weryfikacja Autentyczności Leku” opracowanej przez KOWAL (Krajową Organizację Weryfikacji Autentyczności Leków).
Perspektywa pacjenta – głos z forum 🗣️
Maria, 62 lata, choroba zwyrodnieniowa stawu kolanowego: „Przyjmowałam Hyalgan co 6 miesięcy. Po informacji o wycofaniu zadzwoniłam do lekarza, który zaproponował mi Ostenil. Cena podobna, efekt również, ale cieszę się, że ktoś czuwa nad bezpieczeństwem.”
Wnioski i rekomendacje ✅
• Wycofanie dotyczy wyłącznie serii H19960 i F32680 – nie oznacza to globalnego zakazu stosowania kwasu hialuronowego. • Pacjent ma prawo do zwrotu produktu i otrzymania refundacji lub zamiennika. • Lekarze powinni poinformować pacjentów podczas najbliższej wizyty lub telefonicznie. • Apteki, które nie zareagują na decyzję GIF, narażają się na kary finansowe i cofnięcie zezwolenia.
Najczęstsze pytania (FAQ) ❓
Czy inne serie Hyalgan są bezpieczne? Tak, pod warunkiem że na kartoniku widoczna jest integralna plomba ATD.
Czy mogę przechowywać Hyalgan w lodówce? Tak, zaleca się temperaturę 2–25 °C, ale chronić przed mrozem.
Skąd mam pewność, że zamiennik nie zostanie wycofany? Sprawdzaj komunikaty na stronie GIF i wybieraj aptekę, która prowadzi ewidencję elektroniczną produktów.
Podsumowanie 📝
Decyzja Głównego Inspektora Farmaceutycznego to jasny sygnał, że nawet najmniejsze uchybienia w opakowaniu mogą skutkować pełnym wycofaniem z obrotu. Choć producent twierdził, że ryzyko sfałszowania jest niewielkie, prawo stawia bezpieczeństwo pacjenta na pierwszym miejscu. Posiadasz Hyalgan z serii H19960 lub F32680? Nie ryzykuj – zwróć produkt do apteki i wybierz alternatywę. 🛡️
Źródła: 1. "Decyzja nr 25/WC/ZW/2025" – komunikat GIF, 18.07.2025, https://www.gov.pl/web/gif 2. Rozporządzenie Delegowane Komisji (UE) 2016/161, EUR-Lex, https://eur-lex.europa.eu 3. Ustawa "Prawo farmaceutyczne" – tekst jednolity, ISAP, https://isap.sejm.gov.pl 4. Dane katalogowe Fidia Farmaceutici S.p.A., https://www.fidiapharma.com